質量モル濃度 質量モル濃度は、沸点上昇・凝固点降下の場面でしか出番がなく、質量パーセント濃度、モル濃度に比べて重要性は高くありません。 質量モル濃度とは、溶媒1(kg)の中に溶質がどれほどの量とけているのか(mol)を示したものです。 溶質水酸化ナトリウムの質量パーセント濃度をモル濃度に変換します。 0 % 以上 522 % 以下の誤差 (標準偏差)は ±パーセント濃度は、溶質の質量÷溶液の質量×100です。<数式の挿入> ②で求めた溶質の質量÷①で求めた溶液の質量×100で求められるので、<数式の挿入> 438 ÷ 10 ×100= 365% <数式の挿入> これより、求める質量パーセント濃度は365%となります。
中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu
質量 パーセント 濃度 問題 応用
質量 パーセント 濃度 問題 応用-31 質量パーセント濃度 100 gの溶液を考えたときに,そこに何gの溶質が溶けているかをパーセ ントであらわす方法が質量パーセント濃度である.質量パーセント濃度をあ らわす単位は%である*1.たとえば100 gの塩化ナトリウム水溶液があり,こ10 = 02 つまり mol% になります。 ※mol%よりも、 m o l / L という単位(1リットルの溶液あたり何molの溶質が溶けているか)が



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ
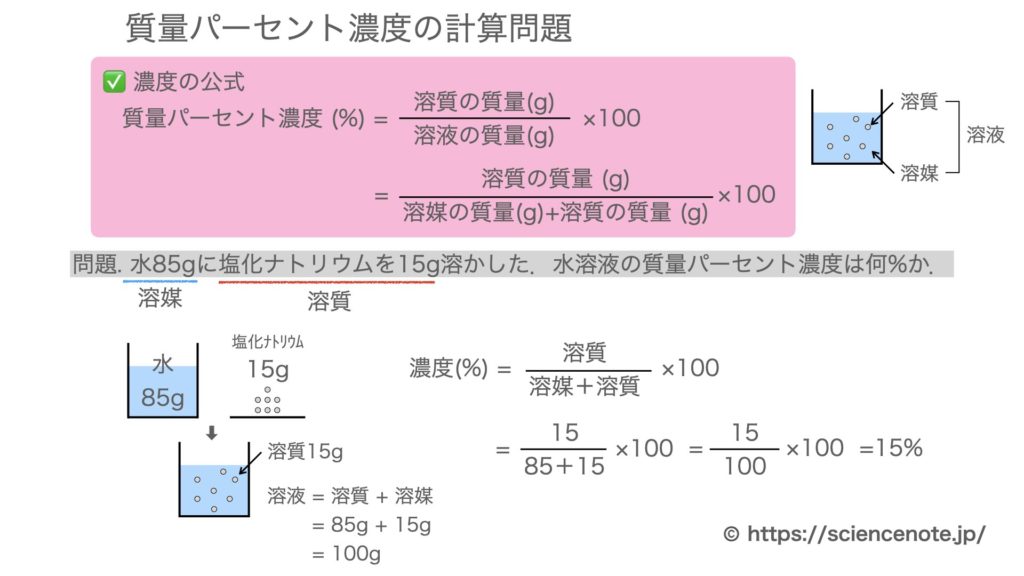
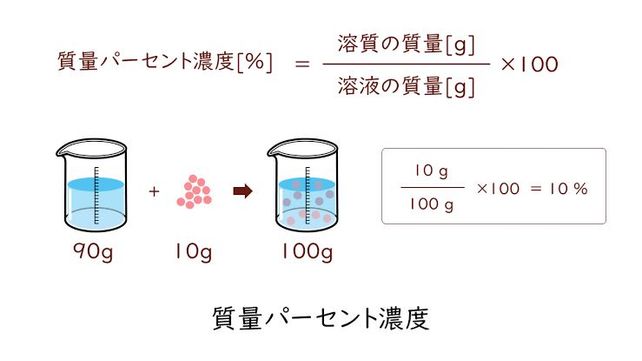
100 = 4761%となります。 従って100グラムの水に含まれている水酸化ナトリウム5グラムの質量パーセント濃度は必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問153 モル分率から質量パーセント濃度を求める方法を教えてください. 回答 溶媒の質量パーセント濃度 質量パーセント濃度(%)= 溶質の質量(g) 溶液の質量(g) ×100 例 90gの水に10gの塩化ナトリウムをとかしたら、 100gの塩化ナトリウム水溶液になる。 このとき 溶質10g, 溶液(溶媒溶質)100gなので 濃度は
全体のモル で計算できます。 例えば、2mol の物質Aと、8mol の物質Bを混ぜてできた混合液における、物質Aのmol%は、 2 ÷質量パーセント濃度は、 塩酸100gあたりに溶けている塩化水素の質量 です。 だから、単純に100をかけてあげたらOKですね。 塩酸1g の中に 005g の塩化水素なのだから、塩酸100g の中には、その100倍の5g の塩化水素が溶けています。量パーセント濃度を25%にします。水を何g蒸発させればよいで すか。 ①質量パーセント濃度6%の砂糖水500gには、何g砂糖が溶けて いるか、ということから求める。先ほどの式 から、 500 質量パーセント濃度(%) = 溶けている溶質の質量
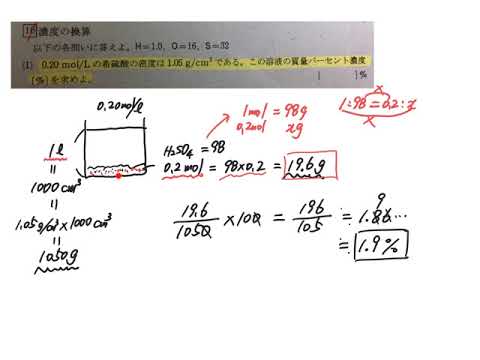
使用目的 2mol/L が7%出会っているのか計算した。 ご意見・ご感想 molから質量パーセント濃度を出せるようにしてほしい。 アンケートにご協力頂き有り難うございました。 送信を完了しました。 塩酸の濃度変換 のアンケート記入欄 性別答えが質量パーセント濃度です。 例1: (5/105) ×100 = ×




H30 1 4 4 質量パーセント濃度 On Vimeo




Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ
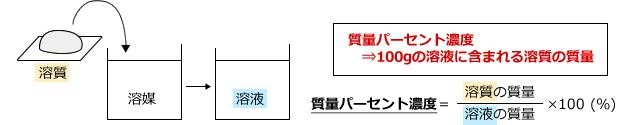
は,質量パーセント濃度,若しくは重量パーセント濃度という。溶液も溶質も質量 gの場合であり,w/w% のほかwt% やmass%という表し方もある。単に%の場合は,こ れを指す場合が多い。w/w% = 溶質の質量g 溶液の質量g ×100 で表す。 w/v% は,質量体積パーセント濃度,若しくは質量容積パーセント濃度といい,分子が溶質 の質量質量パーセント濃度を求めるには、公式にあてはめれば一瞬。 質量パーセント濃度は 15% でした。 食塩水が100gあれば、その中に15gの食塩が溶けているくらいの濃さ、ってことです。質量パーセント濃度とは 質量パーセント濃度とは、溶質の質量 gを溶液全体の質量 gで割って100をかけたものです。




中1理科 質量パーセント濃度 身のまわり物質12 イメージで簡単理解 勉強 Youtube スタディチューブ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
質量パーセント濃度(重量パーセント濃度)といいます。 単位:w/w% wt% mass% 単位が%だけの場合、この質量パーセント濃度を指すことが多いです。 ② 嵩(かさ) 溶けている物の嵩mL ÷質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×1003 同上の質量パーセント濃度を計算し、求める 4 平衡状態のモデル図を描き、飽和水溶液を正しく理解する 5 食塩水溶液から食塩を再結晶させる準備をする



水溶液と質量パーセント濃度の計算問題 Hiromaru Note




質量パーセント濃度 On Apple Books
Mol%は「モルパーセント」と読むことが多いです。 モルパーセントは、 溶質 (溶かしている物質)のモル ÷質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。濃度の変換問題は,質量パーセント濃度% ⇔ モル濃度mol/L の変換が頻出となる。 Ⅰ質量パーセント濃度に関する問題タイプ Ⅱモル濃度に関する問題タイプ ・質量パーセント濃度:溶液中に溶けている溶質の質量を百分率で表した濃度。溶液100gあたりの




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



気体の溶解度
濃度と水溶液の質量が問題文に書いてあればすぐ溶質の質量を求めるくせをつけると理解が早いと思います。 例題もまず自分で考えてみて、「解き方」を見てください。 質量パーセント濃度の応用問題の解き方 公式をもう一度確認しておきましょう。質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100 では、実際に計算してみましょう。 溶液の質量は250gで、溶質の質量は50gです。 このことから、質量パーセント濃度は、次のようになります。 (50/250)×100=% よって、答えは、 「%」 となります。(質量パーセント濃度 から転送) 出典 フリー百科事典『ウィキペディア(Wikipedia)』 ( 0007 UTC 版) 濃度(のうど)は、従来、「溶液中の溶質の割合を濃度という、いろいろな表し方がある。質量パーセント濃度、モル濃度等」(日本化学会編 第2版標準化学用語辞典)と定義されている。




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月



H30 1 4 4 質量パーセント濃度 On Vimeo
Mol/L です。 本ライブラリは会員の方が作成した作品です。 内容について当サイトは一切関知しません。濃度を示す指標として 質量パーセント濃度 があります。これは、溶液100g中に溶質がどれだけ溶けているかを示すものです。 式で表すと、 質量パーセント濃度=溶質÷溶液×100 となります!後ろに100を掛けているのは、出てきた値を百分率で表したいからです。100 溶液の質量(g) 溶質の質量(g) = ×




モル濃度と質量パーセント濃度 Youtube




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear
ガクト濃度計算機 ※4つの項目のうち、2つに数値を入れてください。 空欄の数値を求めることができます。 ※数値は半角数字で入れてください。質量パーセント濃度を英語で訳すと percent concentration of mass 約1179万語ある英和辞典・和英辞典。 発音・イディオムも分かる英語辞書。 質量パーセント濃度 percent concentration of mass質量パーセント濃度 質量パーセント濃度は溶液 100g に含まれる溶質の質量(g)のこと。



溶液の濃度 問題



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
質量パーセント濃度の公式 水溶液全体に対する溶質の質量の割合を「%」で表したものです。 この2つの式で問題を解いていきます。実際にやってみましょう。例題1 水114gに食塩を6gとかしたとき、何%の食塩水が何g できるか。「質量パーセント濃度」 溶液の質量に対する溶質の質量の割合を 百分率で示したもの 求め方 質量パーセント濃度(%) 溶質の質量(g) = ×モル濃度とは、溶質のモル (mol)/溶液の体積 (L)で表される、入試必出の知識です。 本記事では、溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性について、図と入試頻出の練習問題でわかりやすく解説します




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ
質量パーセント濃度 計算問題 次の問いに答えよ。 (1) 砂糖水250gがある。この中に砂糖がg溶けている場合、この砂糖水の質量パーセント濃度は何%か。ハードル2:パーセントは単位ではない 6:左は濃度005、右は濃度0048でよい(質量で比較した濃度) → 濃度にパーセントをつける必要はない → しかし、より分かりやすくするためにパーセントという接尾語をつける




高校化学 中和滴定などの問題 質量パーセント濃度以外 どれも自分の力 化学 教えて Goo



たんくん على تويتر 教えた覚えあるよー その時はモル濃度と質量パーセント濃度は別やったけどな これは少し無理やりつけた感がある Rt Hanpen52 おお 懐かしい こんなの昔頭の中にありましたね




この問題の 3 の解き方をわかりやすく教えてください Clear




質量パーセント濃度に関する問題です までは自力で解解くことができましたが がどう Clear




中学1年の理科 動画 質量パーセント濃度の問題 水溶液 19ch



5 56 oog B1oog See How To Solve It At Qanda




中学理科 計算問題 質量パーセント濃度の計算 Youtube




溶液の濃度 無料で使える中学学習プリント




質量パーセント濃度の計算問題集 基本編 Menon Network



化学 Mol濃度 質量パーセント濃度 Youtube




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度 塾の質問箱




濃度について 質量パーセント W W と質量体積パーセント W v 生涯学人 まなびと 楽しいサイエンス 暮らしはサイエンス 子供たち サイエンスを感じて




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



1



公式を使う




溶液の濃度に関する問題 完全攻略チャート 過去問解説集 自宅でできる受験対策ショップ ワカルー Wakaru



1



1



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム




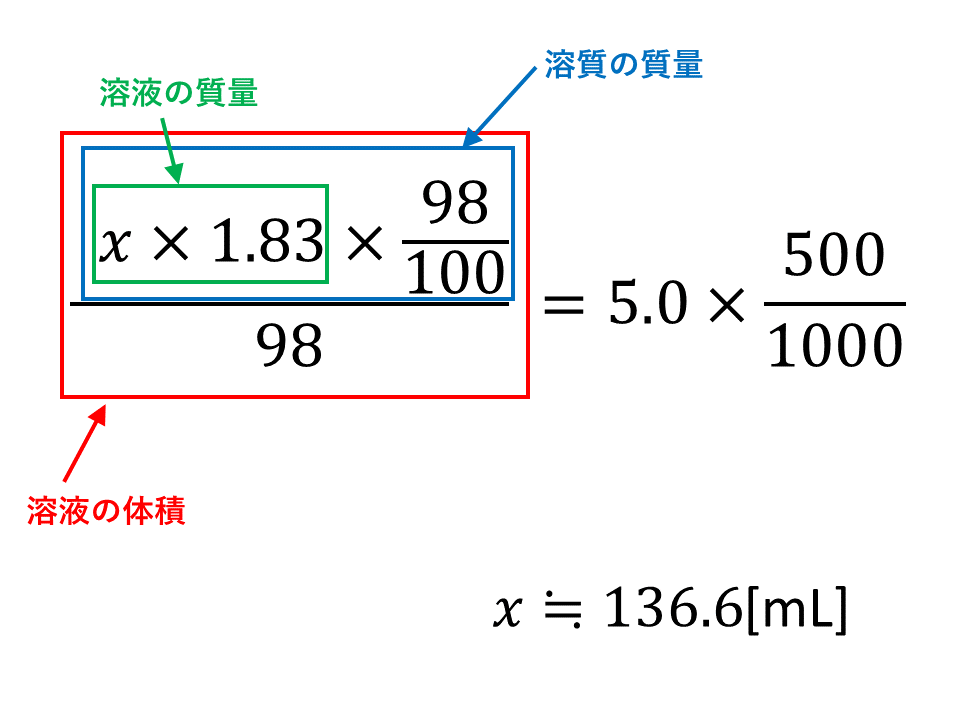
至急 質量パーセント濃度が98 の濃硫酸の密度は1 8g Cm3である この 高校 教えて Goo




化学勉強法 センター試験09 Mol濃度から質量パーセント濃度へ 大村の化学勉強法




4 6 溶液の濃度 おのれー Note




Pictngamukjppqzk Telecharger L Image 質量 パーセント 濃度 の 求め 方 2618
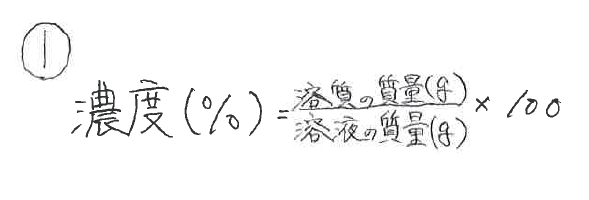



濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ




0g Descubre Como Resolverlo En Qanda



溶質を求める




高校受験対策 理科 質量パーセント濃度 熱量 の問題 動画 19ch
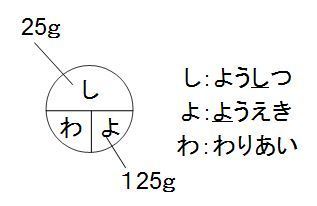



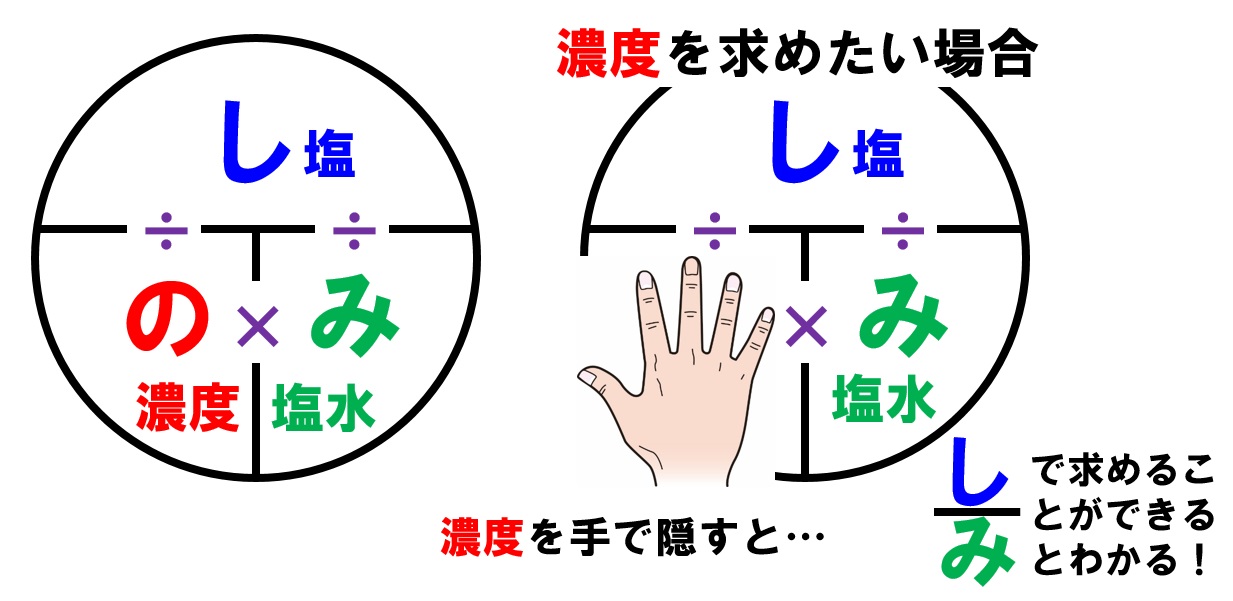
しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ
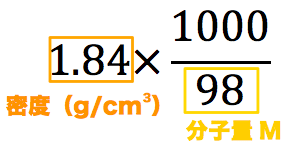



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




質量パーセント濃度の計算問題集 応用編 Menon Network



92 Descubre Como Resolverlo En Qanda



1



濃度の応用




科学 水溶液の性質 Flashcards Quizlet
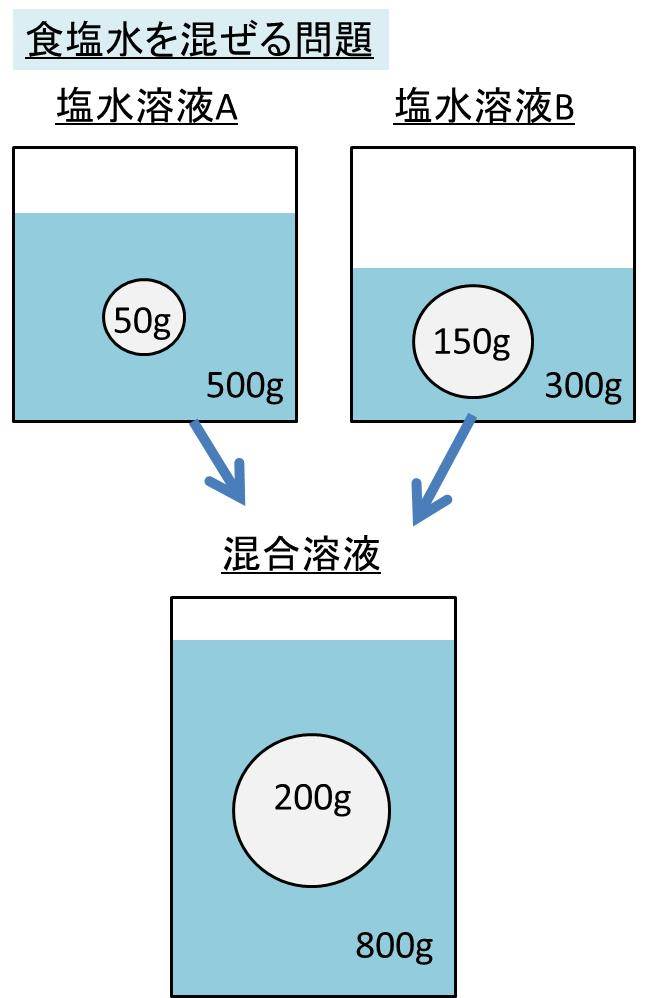



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




3 10 0g See How To Solve It At Qanda




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット




腎臓 計算に必要な基礎知識 濃縮率の求め方 せいぶつ農国




モノマナビ研究所



Www Jupiterimages Com



金魚の薬浴のための0 5 食塩水の作り方 質量パーセント濃度 金魚道楽




世界一雑な高校化学動画 モル濃度と質量パーセント濃度 Skmkchem Youtube
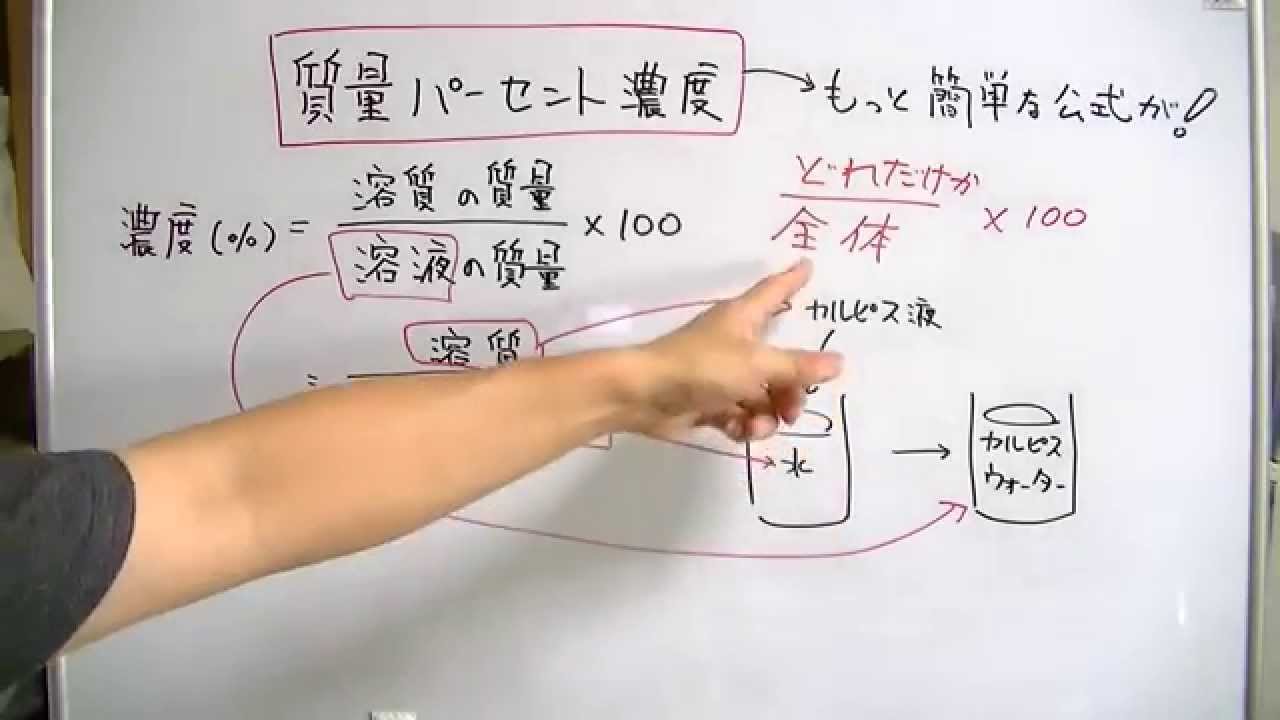



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube
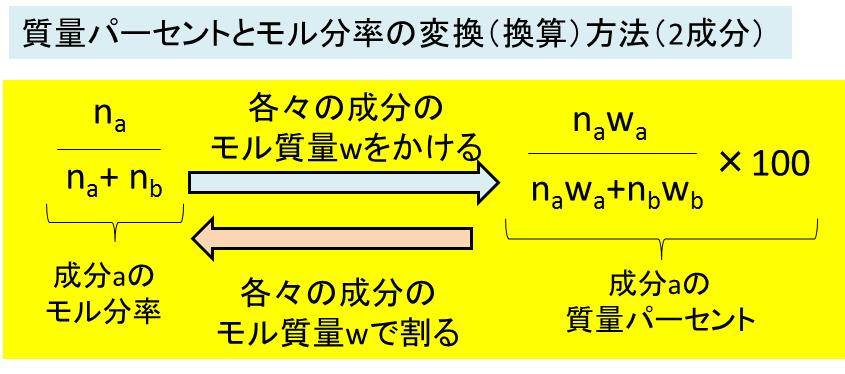



質量パーセントとモル分率の変換 換算 方法 計算




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ
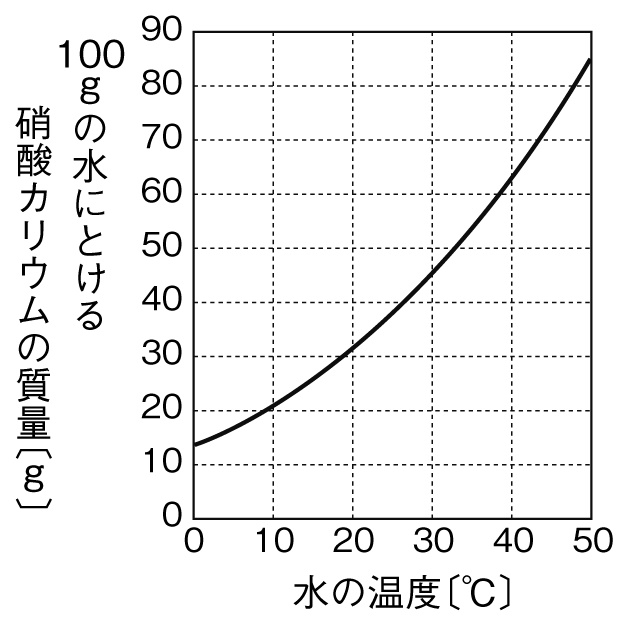



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




質量パーセント濃度の求め方とモル濃度の違い



基礎化学3 溶液




Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook




質量パーセント濃度 密度で求められるのは質量ですか Clear




質量パーセント濃度 1




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン
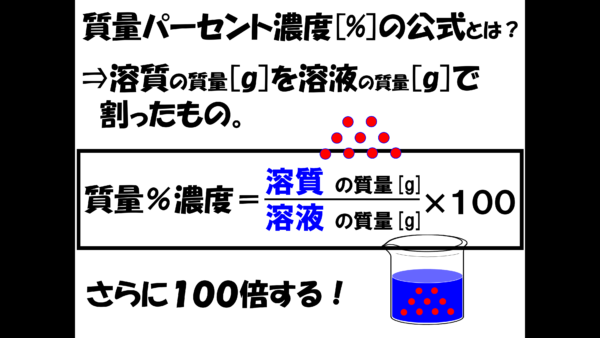



危険物資格取得のための高校化学no 1 濃度計算 F M サイエンスブログ




برچسب 質量パーセント濃度 در توییتر
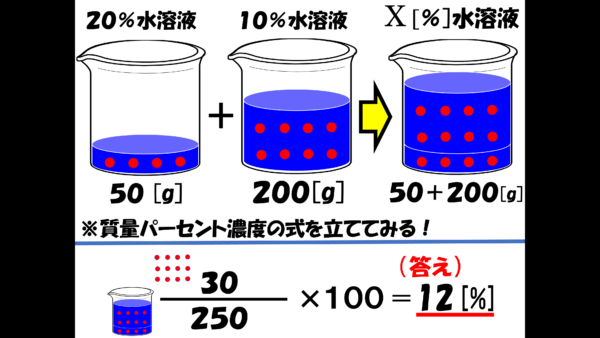



危険物資格取得のための高校化学no 2 濃度計算 F M サイエンスブログ




中1 理科 中1 32 質量パーセント濃度 Youtube
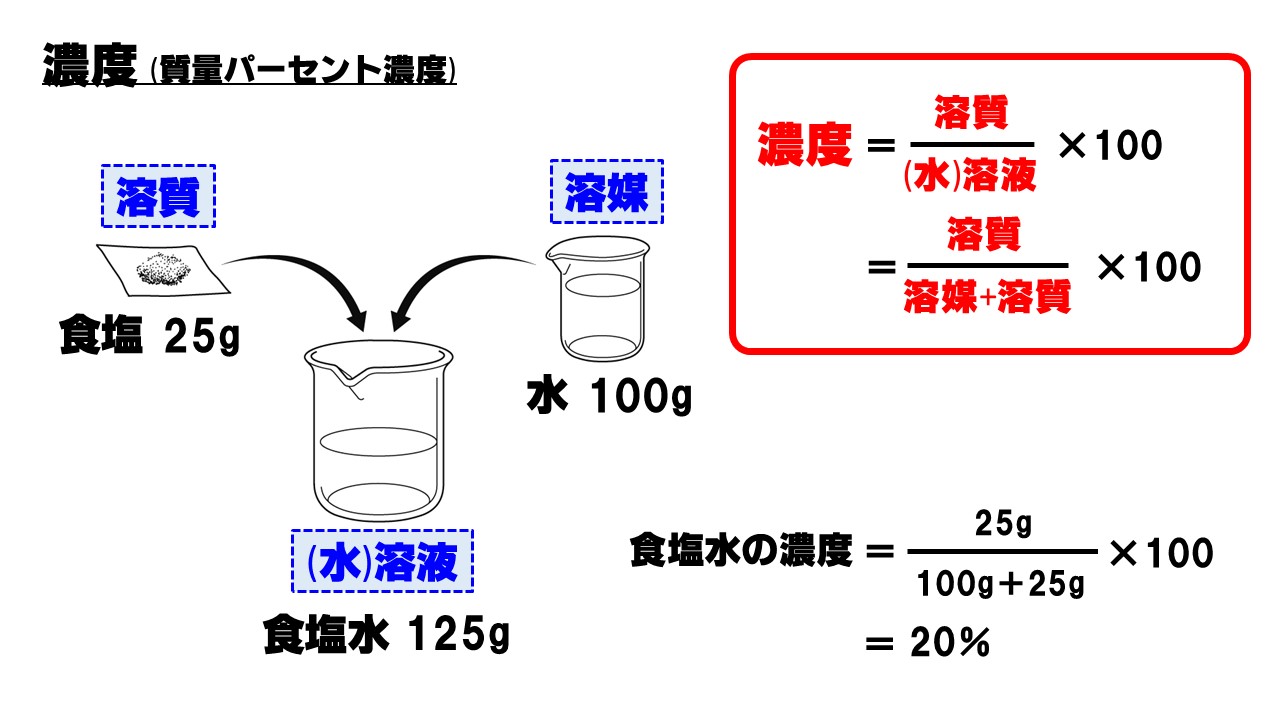



中1理科 濃度 質量パーセント濃度 のポイント Examee




中1 理科 質量パーセント濃度の計算 P塾




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




4 6 溶液の濃度 おのれー Note




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度 Japaneseclass Jp




エレガント質量 パーセント 濃度 最高のぬりえ




4 6 溶液の濃度 おのれー Note



5 56 oog B1oog See How To Solve It At Qanda




モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




4 15 1g 1 Descubre Como Resolverlo En Qanda
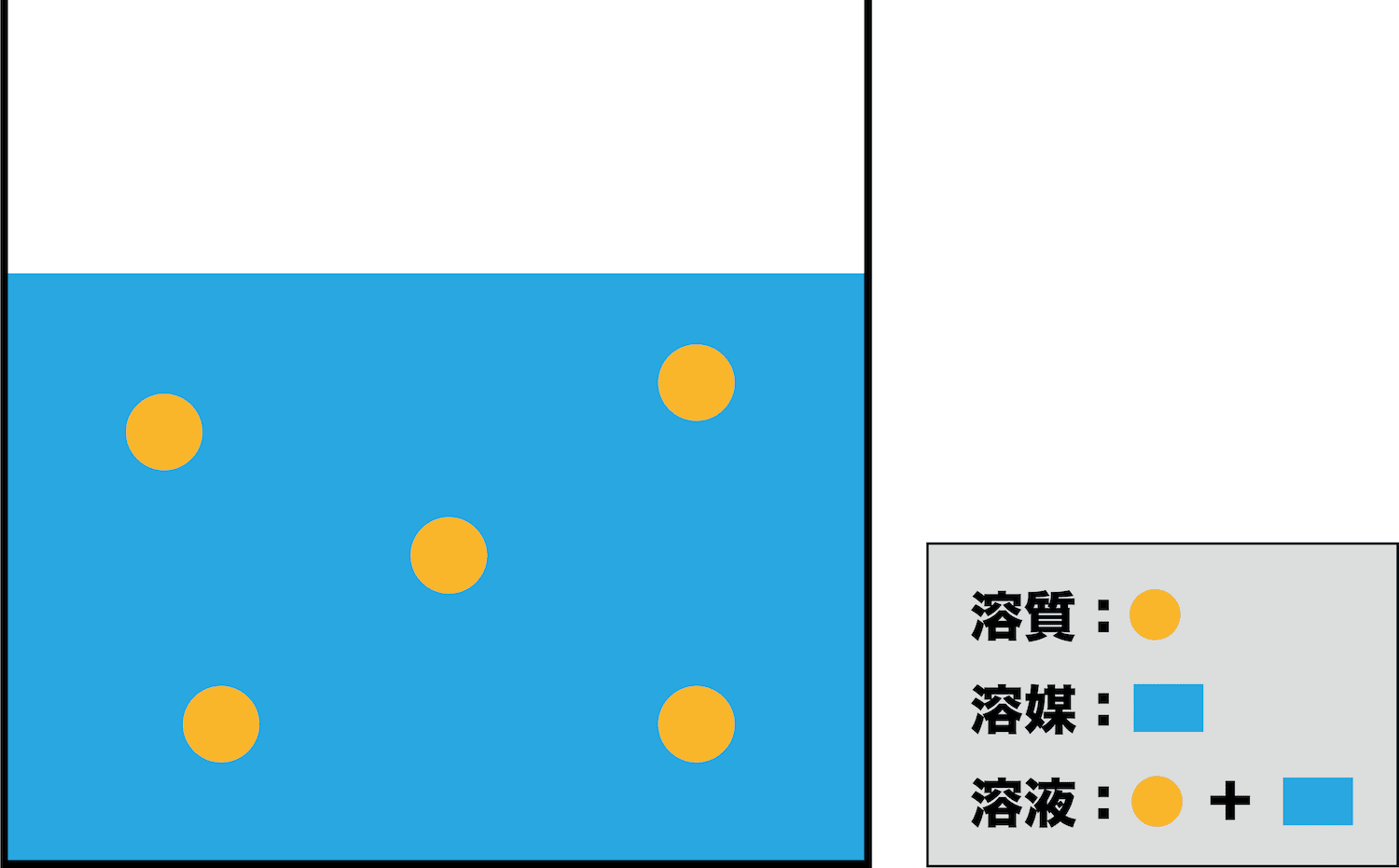



濃度計算の公式 解き方 質量パーセント濃度 モル濃度 質量モル濃度 化学のグルメ



モル濃度 Okedic



食酢の質量パーセント濃度ってどうやって求めるんですか C 1 Yahoo 知恵袋




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度




演習問題 問68 薬がみえるvol 4




質量パーセント濃度 基準を統一する科学者たち Menon Network



質量パーセント濃度中1です 理科の質量パーセント濃度が解けませ Yahoo 知恵袋




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット



中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋




モル濃度から質量パーセント濃度に変えることは可能ですか Clear
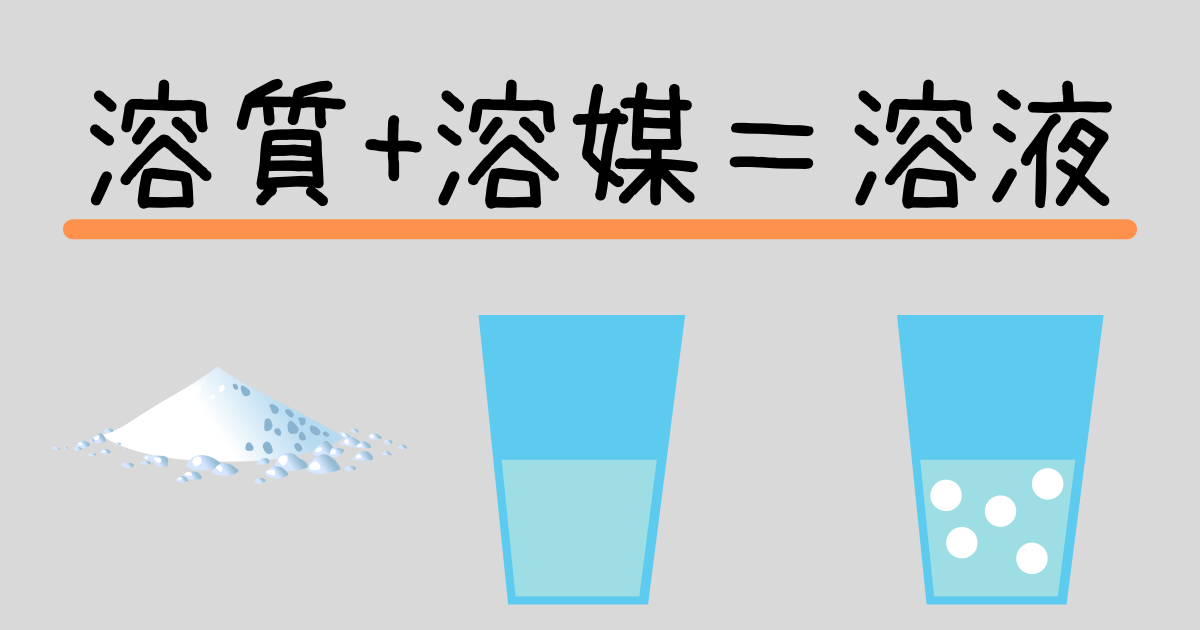



水溶液と質量パーセント濃度の計算問題 Hiromaru Note



2




理科 中1 27 質量パーセント濃度 Youtube




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト



0 件のコメント:
コメントを投稿